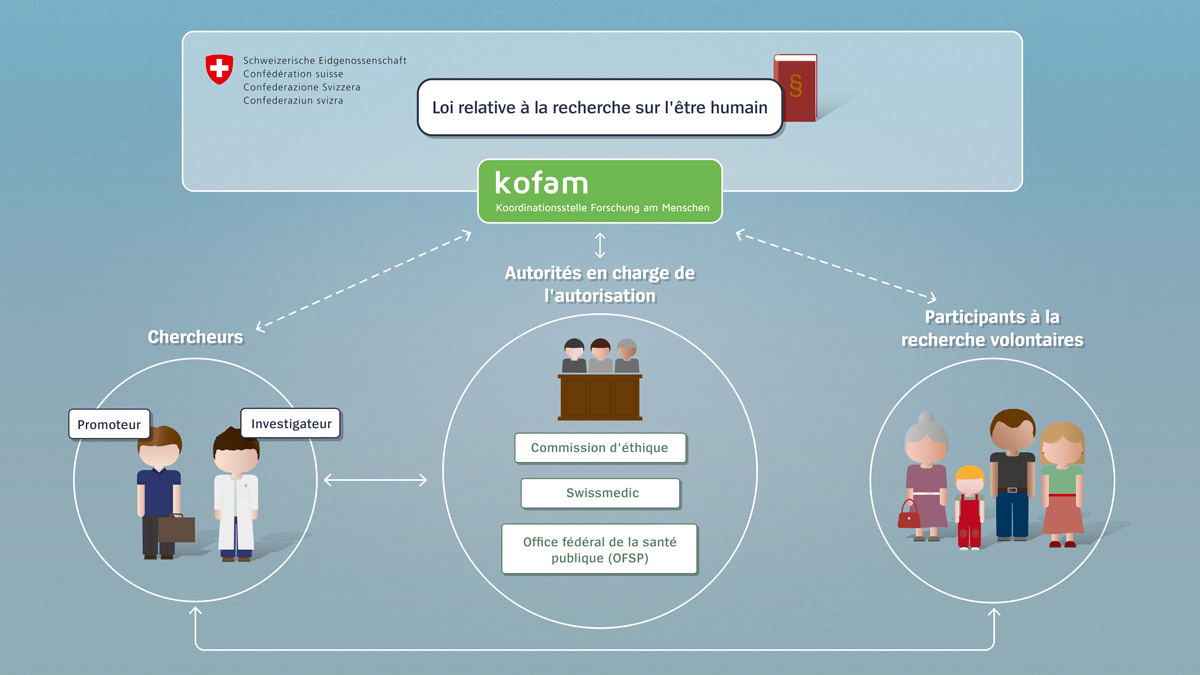
Chercheurs
Par chercheur, on entend aussi bien l’investigateur, c’est-à-dire la personne réalisant l’étude, que le promoteur, à savoir l’initiateur du projet. Dans le cas des études initiées par l’investigateur, ce dernier endosse également le rôle du promoteur. Avant de pouvoir débuter, tout projet de recherche entrant dans le champ d’application de la loi doit avoir été préalablement autorisé. Les chercheurs ont donc l’obligation de soumettre aux autorités une demande d’autorisation pour leur projet.
Les chercheurs sont tenus de donner préalablement aux participants à la recherche toutes les explications utiles sur le projet et d’obtenir d’eux leur libre consentement à y participer. Au cours du projet, ils ont en outre l’obligation d’annoncer tout incident particulier aux autorités en charge de l’autorisation.
Participants à la recherche
Par participants à la recherche, on entend les personnes qui prennent part à un projet. Ils le font de leur plein gré et après avoir été préalablement informés par le chercheur. Ils ont le droit de mettre fin à leur participation à tout moment. En revanche, tant qu’ils participent au projet de recherche, ils ont le devoir de se conformer aux directives.
Autorités en charge de l’autorisation
Par autorités en charge de l’autorisation, on entend, d’une part, les commissions d’éthique cantonales et, d’autre part, l’Institut suisse des produits thérapeutiques (Swissmedic) ainsi que, dans certains cas, l’Office fédéral de la santé publique (OFSP) et l’Office fédéral de l’environnement (OFEV). Les autorités examinent les demandes et autorisent les projets de recherche. Les chercheurs les informent régulièrement des événements imprévus ; si nécessaire, elles peuvent intervenir, voire, dans les cas extrêmes, interrompre un projet de recherche.
Confédération
En tant que quatrième acteur, la Confédération fixe le cadre à travers la loi relative à la recherche sur l’être humain. Elle assume, par le biais de l’Organe de coordination de la recherche sur l’être humain (kofam), des tâches de coordination et diffuse des informations. Cet organe permet, par exemple, aux chercheurs de se renseigner sur les procédures d’autorisation ou à toute personne intéressée de consulter un registre des projets de recherche.
Plus d’informations
Commissions cantonales d’éthique
Les commissions d’éthique ont pour mission d’évaluer les projets de recherche sur les plans éthique, scientifique et juridique. Dans le cas des essais cliniques, elles contrôlent que les bonnes pratiques cliniques (Good Clinical Practice, GCP) sont respectées. Elles recueillent également les annonces et les rapports portant sur de tels essais. Elles peuvent, le cas échéant, poser des conditions supplémentaires ou suspendre l’autorisation d’un projet.
- Ethikkommission Bern
(canton de Berne)
- Commission d'éthique Genève
(canton de Genève)
- Ethikkommission Nordwest- und Zentralschweiz
(cantons d'Argovie, de Bâle-Campagne, de Bâle-Ville, du Jura, de Lucerne, de Nidwald, d'Obwald, de Soleure, de Schwyz, d'Uri, de Zoug)
- Ethikkommission Ostschweiz
(cantons de St-Gall, d'Appenzell Rhodes-Intérieures, d'Appenzell Rhodes-Extérieures, de Thurgovie)
- Comitato etico cantonale
(canton du Tessin)
- Commission d'éthique Vaud
(cantons de Vaud, de Neuchâtel, de Fribourg et du Valais)
- Ethikkommission Zürich
(cantons de Zurich, de Glaris, des Grisons, de Schaffhouse et Principauté de Liechtenstein)
Swissmedic
Swissmedic est l’autorité d’autorisation et de contrôle des médicaments et des dispositifs médicaux (produits thérapeutiques) en Suisse. Dans le cadre des essais cliniques portant sur les dispositifs médicaux, l’institut vérifie que l’essai clinique tient compte des risques liés aux produits et que les données relatives aux produits correspondent à l’état de la science et figurent correctement dans le protocole. Dans le cadre des essais cliniques portant sur les médicaments, Swissmedic vérifie que ces derniers satisfont aux exigences en matière de sécurité et de qualité. Swissmedic autorise également les essais cliniques de thérapie génique et de transplants standardisés. Il peut en tout temps procéder à une inspection des essais cliniques impliquant des produits thérapeutiques ou des transplants standardisés. Il contrôle ainsi que les prescriptions légales et les directives internationales sont respectées.
Office fédéral de la santé publique (OFSP)
La division Radioprotection de l’OFSP est chargée d’exécuter la loi sur la radioprotection (LRaP) ainsi que de l’ordonnance sur la radioprotection (ORaP). Sa mission consiste à protéger l’être humain et l’environnement contre les dangers du rayonnement ionisant. Si, lors d’un projet de recherche, des examens sont effectués au moyen de sources de rayonnement scellées ou non scellées (p. ex., un produit radiopharmaceutique) dont la dose effective est supérieure à 5 mSv par an, l’OFSP émet un avis sur le respect de la législation en matière de radioprotection ainsi que sur l’évaluation de la dose. L’OFSP vérifie également la conformité à la législation sur la radioprotection ainsi que l’estimation de la dose pour certains essais cliniques impliquant des produits thérapeutiques susceptibles d’émettre un rayonnement ionisant.
Avant de pouvoir débuter, les essais cliniques de transplantation d’organes, de tissus ou de cellules doivent être autorisés par la section Transplantation et procréation médicalement assistée de l’OFSP. L’OFSP peut procéder en tout temps à des inspections lors d’essais cliniques de transplantation.
Par ailleurs, la section Sécurité biologique et génétique humaine de l’OFSP rend un avis sur les essais cliniques de thérapie génique ainsi que sur les essais cliniques avec des organismes génétiquement modifiés ou pathogènes.
Office fédéral de l’environnement (OFEV)
Pour les essais cliniques de thérapie génique et ceux impliquant des organismes génétiquement modifiés ou pathogènes, la section Biotechnologie de l’OFEV évalue les données environnementales et rend un avis sur la demande. L’avis de la Commission fédérale d’experts pour la sécurité biologique (CFSB) doit également être sollicité.